Tillverkning av intravaskulära litotripsienheter 2025: Avslöjande av genombrott, marknadsdynamik och nästa våg av kardiovaskulär innovation. Utforska hur denna sektor kommer att förändra patientutfall och branschens intäkter.
- Sammanfattning: Viktiga insikter och höjdpunkter för 2025
- Marknadsöversikt: Definition av tillverkning av intravaskulära litotripsienheter
- Marknadsstorlek och tillväxtprognos för 2025 (2025–2030): CAGR, intäktsprognoser och regionala trender
- Drivkrafter och utmaningar: Vad driver och hindrar marknadens expansion?
- Konkurrenslandskap: Ledande tillverkare, nya aktörer och M&A-aktiviteter
- Teknologiska innovationer: Nästa generations litotripsienheter och FoU-pipelines
- Regulatorisk miljö: Godkännanden, standarder och efterlevnad 2025
- Adoptionsövervakning: Klinisk användning, läkares perspektiv och patientutfall
- Leveranskedja och tillverkningsförbättringar: Automation, material och kostnadsoptimering
- Framtidsutsikter: Störande teknologier, marknadsmöjligheter och strategiska rekommendationer
- Bilaga: Metodik, datakällor och marknadstillväxtberäkning (Beräknad CAGR: 13,2% från 2025 till 2030)
- Källor och referenser
Sammanfattning: Viktiga insikter och höjdpunkter för 2025
Tillverkningssektorn för intravaskulära litotripsienheter (IVL) är redo för betydande framsteg och marknadsexpansion 2025. IVL-teknologin, som utnyttjar akustiska tryckvågor för att säkert bryta ner vaskulär kalcium under perkutana interventioner, fortsätter att vinna mark som en föredragen lösning för behandling av komplexa förkalkade krans- och perifera artärer. År 2025 förväntas en robust tillväxt, drivet av ökad klinisk användning, teknologisk innovation och utvidgade regulatoriska godkännanden.
Viktiga insikter för 2025 framhäver den växande efterfrågan på minimalt invasiva kardiovaskulära ingrepp, där IVL-enheter erbjuder ett säkrare och mer effektivt alternativ till traditionell aterektomi och högtrycksballongangioplastik. Ledande tillverkare såsom Shockwave Medical, Inc. ligger i framkant och investerar i forskning och utveckling för att förbättra enheternas effektivitet, användarupplevelse och procedurresultat. Integrationen av IVL med bildbehandlingsmetoder och design av nästa generations katetrar förväntas också ytterligare förbättra precision och säkerhet.
Regulatorisk momentum är en annan kritisk drivkraft. År 2025 förväntas fler IVL-enheter få godkännanden från stora hälsomyndigheter, inklusive den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) och den europeiska läkemedelsbyrån (EMA), vilket underlättar bredare marknadstillgång och användning. Strategiska partnerskap mellan enhetstillverkare och vårdgivare accelererar även klinisk utbildning och träning, vilket säkerställer optimal användning och patientutfall.
Från ett tillverkningsperspektiv ligger fokus på att öka produktionskapaciteten samtidigt som stränga kvalitetsstandarder upprätthålls. Företag utnyttjar avancerade tillverkningsteknologier, såsom automation och precisionsengineering, för att möta den växande globala efterfrågan och efterkomma förändrade regulatoriska krav. Hållbarhetsinitiativ, inklusive miljövänliga material och avfallsminskning, integreras alltmer i tillverkningsprocesserna.
Sammanfattningsvis är 2025 ett avgörande år för tillverkningen av intravaskulära litotripsienheter. Konvergensen av kliniska behov, teknologiska framsteg, regulatoriskt stöd och tillverkningsinnovationer positionerar sektorn för fortsatt tillväxt och förbättrad patientvård världen över. Intressenter i hela värdekedjan – från tillverkare som Shockwave Medical, Inc. till vårdgivare – förväntas dra nytta av dessa transformativa trender.
Marknadsöversikt: Definition av tillverkning av intravaskulära litotripsienheter
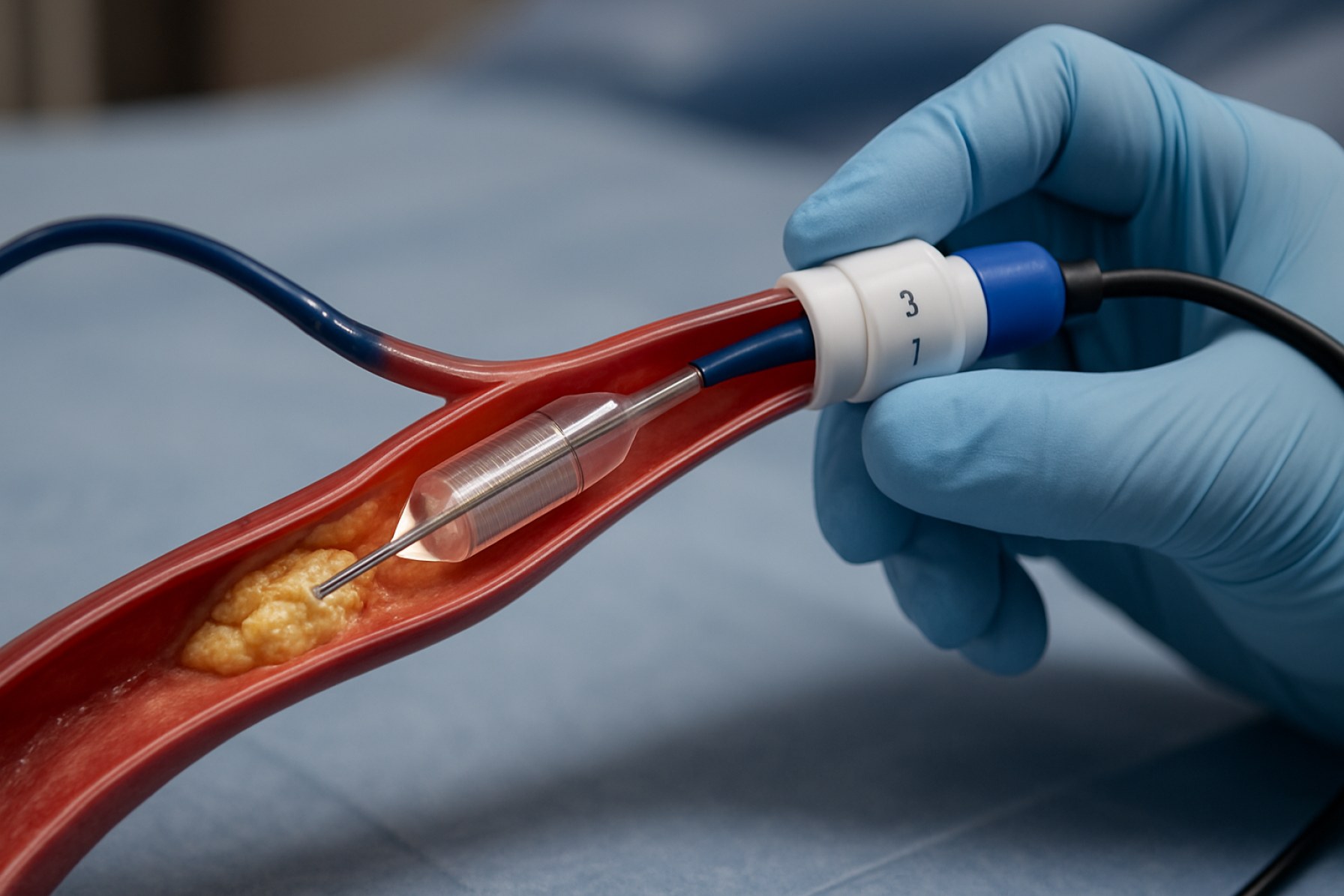
Intravaskulära litotripsienheter (IVL) representerar en transformativ teknologi i behandlingen av förkalkade vaskulära lesioner, särskilt inom krans- och perifera artärer. Dessa enheter använder akustiska tryckvågor för att bryta ner intimal och medial kalciumavlagringar, vilket underlättar kärlvidgning och förbättrar effektiviteten av efterföljande ingrepp såsom stentplacering. Tillverkningen av IVL-enheter 2025 kännetecknas av en konvergens av avancerad materialvetenskap, precisionsengineering och sträng regulatorisk efterlevnad, vilket återspeglar sektorens snabba utveckling och växande kliniska användning.
Den globala marknaden för tillverkning av IVL-enheter drivs av den ökande förekomsten av kardiovaskulära sjukdomar, en åldrande befolkning och begränsningarna av traditionell aterektomi och ballongangioplastik i kraftigt förkalkade kärl. Tillverkare fokuserar på utvecklingen av kateterbaserade system som integrerar miniatyriserade litotripsi-utsläppare, robusta ballongmaterial och sofistikerade kontrollenheter. Produktionsprocessen involverar högprecision montering i rena rum, rigorösa kvalitetskontrollprotokoll och efterlevnad av internationella standarder såsom ISO 13485 för tillverkning av medicintekniska produkter.
Nyckelaktörer i tillverkningslandskapet för IVL-enheter inkluderar Shockwave Medical, Inc., som var först med den kommersiella introduktionen av intravaskulär litotripsiteknologi. Andra etablerade medicintekniska företag, såsom Boston Scientific Corporation och Medtronic plc, investerar också i forskning och utveckling för att utöka sina portföljer inom detta segment. Dessa företag utnyttjar sina globala distributionsnätverk, regulatoriska expertis och partnerskap med vårdgivare för att påskynda marknadspenetrationen.
Tillverknings-ekosystemet formas ytterligare av samarbeten med komponentleverantörer, kontraktstillverkare och regulatoriska konsulter. Innovationer inom kateterdesign, energileveranssystem och realtidsbildbehandling är centrala för att behålla konkurrensfördelen. Dessutom måste tillverkare navigera i de föränderliga regulatoriska kraven från myndigheter såsom den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) och Europeiska kommissionen, vilket säkerställer att enheterna uppfyller säkerhets- och effektivitetsstandarder för globala marknader.
Sammanfattningsvis definieras marknaden för tillverkning av intravaskulära litotripsienheter 2025 av teknologisk innovation, robust kvalitetsstyrning och en dynamisk regulatorisk miljö. När kliniska bevis som stöder IVL växer, är tillverkarna redo att spela en avgörande roll i att möta de oadresserade behoven hos patienter med komplex vaskulär förkalkning.
Marknadsstorlek och tillväxtprognos för 2025 (2025–2030): CAGR, intäktsprognoser och regionala trender
Den globala marknaden för intravaskulära litotripsienheter (IVL) är redo för betydande expansion 2025, drivet av ökande förekomst av förkalkad kranskärls- och perifer artärsjukdom, teknologiska framsteg och ökande användning av minimalt invasiva procedurer. Branschanalytiker förutspår en robust tillväxttakt (CAGR) på cirka 12–15% från 2025 till 2030, med globala intäkter som förväntas överstiga 1,5 miljarder dollar i slutet av prognosperioden.
Nordamerika förväntas behålla sin dominans på marknaden för IVL-enheter 2025, tack vare hög vårdkostnad, gynnsamma ersättningspolicyer och tidig användning av innovativa kardiovaskulära teknologier. USA, i synnerhet, drar nytta av en stark närvaro av ledande tillverkare som Shockwave Medical, Inc., som fortsätter att utöka sin produktportfölj och kliniska evidensbas. Europa ligger nära efter, med länder som Tyskland, Frankrike och Storbritannien som investerar i avancerad interventionskardiologisk infrastruktur och stödjer kliniska forskningsinitiativ.
Asien och Stillahavsområdet förutses visa den snabbaste tillväxten under 2025–2030, drivet av ett stort patientunderlag, ökad medvetenhet om endovaskulära terapier och förbättrad vårdinfrastruktur. Nyckelmarknader som Kina, Japan och Indien upplever accelererade regulatoriska godkännanden och strategiska samarbeten mellan lokala distributörer och globala tillverkare. Till exempel har Shockwave Medical, Inc. tillkännagett partnerskap för att utöka sin räckvidd i Asien, medan andra företag investerar i lokal tillverkning och utbildningsprogram.
Intäktsprognoser för 2025 innebär att kranskärls-IVL-enheter kommer att stå för den största delen, vilket återspeglar den växande kliniska preferensen för IVL vid behandling av komplexa kranslesioner. Perifera IVL-enheter förväntas också vinna mark, särskilt vid hantering av förkalkad femoropopliteal och iliac artsjukdom. Marknadens tillväxt stöds ytterligare av pågående kliniska studier, regulatoriska godkännanden, och introduktionen av nästa generations enheter med förbättrade säkerhets- och effektivitetsprofiler.
Sammanfattningsvis är marknaden för tillverkning av intravaskulära litotripsienheter redo för dynamisk tillväxt 2025 och framåt, med regionala trender som lyfter fram Nordamerikas ledarskap, Europas stabila expansion och Asien och Stillahavsområdets snabba framväxt som en nyckeltillväxtmotor. Tillverkare förväntas fokusera på innovation, geografisk expansion och strategiska partnerskap för att fånga nya möjligheter och möta de föränderliga behoven hos interventionskardiologer världen över.
Drivkrafter och utmaningar: Vad driver och hindrar marknadens expansion?
Tillverkningslandskapet för intravaskulära litotripsienheter (IVL) 2025 präglas av en dynamisk interaktion mellan drivkrafter och utmaningar. Å ena sidan driver den ökande globala förekomsten av förkalkad kranskärls- och perifer artärsjukdom efterfrågan på avancerade, minimalt invasiva behandlingsalternativ. IVL-teknologin, som använder akustiska tryckvågor för att bryta ner vaskulär kalcium, erkänns alltmer för sin säkerhet och effektivitet, särskilt i komplexa fall där traditionell angioplastik eller aterektomi kan vara mindre effektivt eller riskabelt. Detta kliniska behov är en primär drivkraft för tillverkarna att innovera och öka produktionen.
Regulatoriskt stöd och strömlinjeformade godkännandevägar i viktiga marknader som USA och Europa stärker också branschens tillväxt. Myndigheter som den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) och Europeiska läkemedelsbyrån har tillhandahållit klara ramar för enhetsutvärdering, vilket påskyndar introduktionen av nya IVL-system. Dessutom accelererar ökande investeringar i forskning och utveckling från ledande medicintekniska företag, såsom Shockwave Medical, Inc., teknologiska framsteg, inklusive förbättrade katetdesign och integrerade bildbehandlingsmöjligheter.
Flera utmaningar dämpar dock tempot i marknadens expansion. Tillverkning av IVL-enheter kräver precisionsengineering och strikt efterlevnad av kvalitetsstandarder, givet enheternas komplexitet och deras kritiska användning vid vaskulära ingrepp. Att köpa högkvalitativa råmaterial och komponenter, såsom piezoelektriska element och biokompatibla polymerer, kan vara svårt och utsatt för störningar i leveranskedjan. Dessutom ökar behovet av specialiserade tillverkningsanläggningar och kvalificerad arbetskraft produktionskostnaderna, vilket potentiellt kan begränsa nya aktörers inträde och påverka enheternas överkomlighet.
En annan betydande hindring är variabiliteten i ersättningspolicyer över olika hälsovårdssystem. Medan vissa länder har etablerat ersättningskoder för IVL-procedurer, ligger andra efter, vilket skapar osäkerhet för tillverkare och vårdgivare. Pågående kliniska prövningar och verkliga bevis är avgörande för att demonstrera kostnadseffektivitet och säkerställa bredare försäkringsskydd.
Sammanfattningsvis drivs tillverkningssektorn för intravaskulära litotripsienheter 2025 av stark klinisk efterfrågan, regulatorisk tydlighet och teknologisk innovation, men möter hinder relaterade till produktionskomplexitet, pålitlighet i leveranskedjan och variabilitet i ersättningarna. Att adressera dessa utmaningar kommer att vara avgörande för fortsatt marknadstillväxt och bredare användning av IVL-teknologi.
Konkurrenslandskap: Ledande tillverkare, nya aktörer och M&A-aktiviteter
Konkurrenslandskapet för tillverkning av intravaskulära litotripsienheter (IVL) 2025 kännetecknas av en dynamisk interaktion mellan etablerade branschledare, innovativa nya aktörer och pågående fusioner och förvärv (M&A) aktiviteter. Marknaden drivs främst av den växande förekomsten av förkalkad kranskärls- och perifer artärsjukdom, vilket har ökat efterfrågan på avancerade, minimalt invasiva behandlingsalternativ.
Bland de ledande tillverkarna fortsätter Shockwave Medical, Inc. att dominera IVL-segmentet genom att utnyttja sin proprietära teknologi och omfattande kliniska evidensbas. Företagets Shockwave IVL-system förblir normen för säkerhet och effektivitet, och dess globala distributionsnätverk har möjliggjort snabb användning i både Nordamerika och Europa. Andra etablerade aktörer, såsom Boston Scientific Corporation, har kommit in på marknaden genom strategiska partnerskap och förvärv, med målet att utöka sina kardiovaskulära portföljer och kapitalisera på den växande IVL-möjligheten.
Konkurrenslandskapet formas ytterligare av nya tillverkares inträde, särskilt från Asien och Europa, som utvecklar alternativa IVL-plattformar och söker regulatoriska godkännanden på viktiga marknader. Dessa nya aktörer fokuserar på miniaturisering av enheter, förbättrade energileveranssystem och kostnadseffektiv tillverkning för att differentiera sig från de etablerade aktörerna. Till exempel utforskar flera företag integreringen av IVL med läkemedelsbelagda ballongteknologier för att förbättra kliniska resultat och bredda området för behandlingsbara lesioner.
M&A-aktiviteter förblir starka, eftersom större medicintekniska företag söker att förvärva innovativa startups och proprietära teknologier för att påskynda sitt inträde på IVL-marknaden. Nyligen genomförda transaktioner har inkluderat både vertikal integration – där tillverkare förvärvar komponentleverantörer för att säkra sina leveranskedjor – och horisontell expansion, med företag som förvärvar konkurrenter för att konsolidera marknadsandelar. Denna trend förväntas fortsätta när marknaden mognar och ersättningsvägar blir mer etablerade.
Sammanfattningsvis kännetecknas konkurrenslandskapet 2025 av snabb innovation, strategiska samarbeten och en kamp för att säkra immateriella rättigheter. När kliniska data som stöder IVL fortsätter att ackumuleras, är det troligt att konkurrensen bland tillverkare intensifieras, vilket driver ytterligare förbättringar i enhetsdesign och utökar tillgången till denna transformativa teknologi.
Teknologiska innovationer: Nästa generations litotripsienheter och FoU-pipelines
Landskapet för tillverkning av intravaskulära litotripsienheter (IVL) utvecklas snabbt, drivet av teknologiska innovationer och robusta FoU-pipelines. Nästa generations IVL-enheter utvecklas för att möta den växande efterfrågan på säkrare, mer effektiva och minimalt invasiva lösningar för behandling av förkalkade vaskulära lesioner, särskilt i komplexa fall av kranskärls- och perifer artärsjukdom.
Nyligen gjorda framsteg fokuserar på att förbättra precisionen och effektiviteten i energileveransen av chockvågor. Tillverkare integrerar sofistikerade mikroelektromechaniska system (MEMS) och avancerade katetdesign för att förbättra inriktningen av förkalkade plack samtidigt som de minimerar skador på omgivande vävnad. Till exempel har de senaste IVL-katetrarna optimerade ballongprofiler och energigivare som möjliggör jämn cirkumferentiell plackmodifiering, vilket minskar risken för kärl dissektion eller perforering.
FoU-pipelines utforskar dessutom integreringen av realtidsbildbehandling och feedbacksystem. Genom att kombinera intravaskulär ultraljud (IVUS) eller optisk koherenstomografi (OCT) med litotripsiplattformar syftar tillverkare till att ge kliniker omedelbar visualisering av plackstörning och kärlrespons, vilket möjliggör mer precisa och personliga ingrepp. Dessa innovationer utvecklas av ledande medicintekniska företag såsom Shockwave Medical, Inc., som fortsätter att utöka sina IVL-portföljer och investera i nästa generations enheter.
Ett annat innovationsområde är miniaturisering och flexibilitet hos IVL-katetrar, vilket möjliggör enklare navigering genom krokiga eller små kärl. Detta är särskilt relevant för behandling av distala kranslesioner eller komplexa perifera anatomier. Tillverkare fokuserar också på att förbättra enheternas kompatibilitet med befintliga interventionsplattformar, såsom läkemedelseluerande stentar och vägledningsledningar, för att effektivisera procedurarbetsflöden och bredda klinisk tillämplighet.
Samarbeten mellan enhetstillverkare och akademiska forskningscentrum påskyndar övergången av nya material och energileveransteknologier till kommersiella produkter. Till exempel främjar partnerskap med institutioner som Mayo Clinic utvecklingen av nästa generations IVL-system med förbättrade säkerhetsprofiler och bredare indikationer.
Med sikte på 2025 är sektorn för tillverkning av IVL-enheter redo för betydande tillväxt, understödd av kontinuerliga investeringar i FoU, regulatoriska godkännanden och adoption av digitala hälsoteknologier. Dessa framsteg förväntas ytterligare förbättra patientutfall och utöka den terapeutiska räckvidden för intravaskulär litotripsi världen över.
Regulatorisk miljö: Godkännanden, standarder och efterlevnad 2025
Den regulatoriska miljön för tillverkning av intravaskulära litotripsienheter (IVL) 2025 präglas av allt strängare standarder och föränderliga godkännandevägar, vilket återspeglar den snabba innovationen och växande kliniska användningen av dessa enheter. Tillverkare måste navigera i ett komplext landskap av internationella och nationella regleringar för att säkerställa produktens säkerhet, effektivitet och marknadstillgång.
I USA fortsätter den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) att reglera IVL-enheter som klass III medicintekniska produkter, vilket kräver förhandsgodkännande (PMA) baserat på robust klinisk evidens. FDA betonar efterlevnad av kvalitetsstyrningsregler (QSR) enligt 21 CFR del 820, vilket kräver rigorösa designkontroller, riskhantering och eftermarknadsövervakning. År 2025 har FDA ytterligare harmoniserat sina krav med internationella standarder, särskilt ISO 13485:2016, för att strömlinjeforma globala inskickningar och underlätta ömsesidiga erkännandeavtal.
Inom Europeiska unionen tillämpar Europeiska kommissionen medicinteknikförordningen (MDR 2017/745), som blev fullt tillämplig 2021 och förblir hörnstenen i enhetsgodkännanden 2025. MDR kräver omfattande klinisk utvärdering, eftermarknadsklinisk uppföljning och unik enhetsidentifikation (UDI) för spårbarhet. Meddelade organ, utvalda av Europeiska kommissionen, spelar en avgörande roll i överensstämmelsebedömning och CE-märkning, vilket säkerställer att IVL-enheter uppfyller viktiga säkerhets- och prestandakrav.
Andra viktiga marknader, såsom Japan och Kina, har också uppdaterat sina regulatoriska ramverk. Läkemedel och medicintekniska enheter (PMDA) i Japan och National Medical Products Administration (NMPA) i Kina kräver lokal klinisk data och efterlevnad av Good Manufacturing Practice (GMP) standarder, med ökad överensstämmelse med internationella normer.
I alla jurisdiktioner måste tillverkare hantera utvecklande standarder för biokompatibilitet, elektromagnetisk kompatibilitet och cybersäkerhet, såsom beskrivs av organisationer som Internationella standardiseringsorganisationen (ISO) och Association for the Advancement of Medical Instrumentation (AAMI). År 2025 lägger regulatoriska myndigheter större tonvikt på verkliga bevis, digital hälsaintegration och hållbarhet i enhetsdesign och tillverkning.
Övergripande beror framgångsrik marknadsinträde och fortsatt efterlevnad för IVL-enhetstillverkare 2025 på en proaktiv regulatorisk strategi, tidigt samarbete med myndigheter och kontinuerlig anpassning till föränderliga globala standarder.
Adoptionsövervakning: Klinisk användning, läkares perspektiv och patientutfall
Adoptionen av intravaskulära litotripsienheter (IVL) i klinisk praxis har accelererat under de senaste åren, drivet av växande bevis för deras effektivitet vid behandling av komplexa förkalkade krans- och perifer artärsjukdomar. Tillverkare såsom Shockwave Medical, Inc. har spelat en avgörande roll i att öka tillgängligheten och klinisk integrering av IVL-teknologi. Från och med 2025 är den kliniska användningen av IVL-enheter särskilt märkbar på interventionskardiologiska centra som hanterar hög volym av patienter med kraftigt förkalkade lesioner, där traditionell ballongangioplastik och aterektomi kan vara mindre effektiv eller medföra högre procedurrisker.
Läkares syn på IVL har utvecklats positivt, där många interventionsspecialister citerar enhetens användarvänlighet, säkerhetsprofil och förmåga att modifiera både ytliga och djupa kalcium utan att orsaka betydande kärlskador. Enkäter och registreringsdata visar att kliniker uppskattar den minimala inlärningskurvan kopplad till IVL-system och det minskade behovet av tilläggsenheter eller räddningsstentar. Godkännandet av IVL från professionella samhällen, såsom American College of Cardiology och Society for Cardiovascular Angiography & Interventions, har ytterligare stärkt läkares förtroende och bidragit till bredare adoption.
Ur ett patientutfalls perspektiv har verkliga och kliniska prövningsdata visat att IVL är kopplat till hög procedurframgång, låga siffror för allvarliga negativa kardiovaskulära händelser och förbättrad kärlpatens jämfört med konventionella tekniker i specificerade patientpopulationer. Inte minst har den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) godkänt flera IVL-enheter för både krans- och perifera indikationer, vilket återspeglar en solid säkerhets- och effektivitetsprofil. Patienter som behandlas med IVL upplever ofta kortare procedurtider, mindre kärl dissektion och snabbare återhämtning, vilket har bidragit till ökad patienttillfredsställelse och livskvalitet.
Inför framtiden förväntas den fortsatta utbyggnaden av tillverkningskapaciteten och pågående klinisk forskning ytterligare driva adoptionen av IVL-enheter. Tillverkare investerar i nästa generations plattformar och bredare indikationsstudier för att möta oadresserade behov inom komplexa vaskulära interventioner och för att befästa IVL:s roll som standardbehandling vid hantering av förkalkad vaskulär sjukdom.
Leveranskedja och tillverkningsförbättringar: Automation, material och kostnadsoptimering
Tillverkningslandskapet för intravaskulära litotripsienheter (IVL) utvecklas snabbt, drivet av framsteg inom automation, materialvetenskap och kostnadsoptimeringsstrategier. IVL-enheter, som använder akustiska tryckvågor för att bryta ner förkalkat plack i blodkärl, kräver precisionsengineering och stränga kvalitetskontroller på grund av deras kritiska roll vid kardiovaskulära ingrepp.
Automation blir alltmer central för produktionen av IVL-enheter. Ledande tillverkare som Shockwave Medical, Inc. investerar i automatiserade monteringslinjer och robotinspektionssystem för att öka konsekvensen, minska mänskliga fel och öka produktionen för att möta den växande globala efterfrågan. Automation underlättar också realtidsövervakning och datainsamling, vilket möjliggör förutsägande underhåll och kontinuerlig processförbättring.
Materialinnovation är ett annat viktigt utvecklingsområde. IVL-katetrar och ballongsystem måste balansera flexibilitet, biokompatibilitet och hållbarhet. Nyligen gjorda framsteg inkluderar användning av avancerade polymerer och förstärkta kompositmaterial som förbättrar prestandan hos enheter samtidigt som risken för kärlskador minimeras. Tillverkare utforskar också beläggningar som reducerar friktion och förbättrar leveransen genom krokiga kärl. Dessa materialval är föremål för rigorös validering och regulatorisk granskning, såsom beskrivs av myndigheter som den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) och Europeiska kommissionen.
Kostnadsoptimering förblir en prioritet, särskilt när vårdsystem världen över söker värdebaserade lösningar. Tillverkare utnyttjar principer för lean manufacturing, digitalisering av leveranskedjan och strategiska inköp för att minska produktionskostnaderna utan att kompromissa med kvaliteten. Till exempel möjliggör partnerskap med specialiserade komponentleverantörer och kontraktstillverkare större flexibilitet och skalbarhet. Dessutom gör digitala leveranskedjeplattformar det möjligt att hantera realtidslager och efterfrågan, vilket minskar svinn och säkerställer snabb leverans av kritiska komponenter.
Hållbarhet får också ökad uppmärksamhet, där företag antar miljövänliga tillverkningsmetoder och återvinningsbara material där det är möjligt. I takt med att IVL-marknaden expanderar förväntas dessa framsteg inom automation, material och kostnadshantering driva bredare adoption och tillgänglighet för denna innovativa teknologi, vilket i slutändan förbättrar patientutfall vid behandling av vaskulär förkalkning.
Framtidsutsikter: Störande teknologier, marknadsmöjligheter och strategiska rekommendationer
Framtiden för tillverkning av intravaskulära litotripsienheter (IVL) är redo för betydande transformation, drivet av störande teknologier, växande marknadsmöjligheter och utvecklande strategiska imperativ. När förekomsten av kardiovaskulära sjukdomar ökar globalt, fortsätter efterfrågan på avancerade, minimalt invasiva lösningar som IVL att växa. Tillverkare investerar alltmer i forskning och utveckling för att förbättra enheternas effektivitet, säkerhet och användarupplevelse, med fokus på att integrera digitala hälsoteknologier och artificiell intelligens för förbättrad procedurplanering och realtidsfeedback.
En av de mest lovande störande trenderna är miniaturisering och förfining av IVL-katetrar, vilket möjliggör åtkomst till mer komplexa och distala vaskulära lesioner. Företag utforskar också användning av nya material och energikällor för att optimera plackmodifiering samtidigt som kärlskador minimeras. Integreringen av smarta sensorer och anslutningsfunktioner förväntas underlätta fjärrövervakning, dataanalys och personligt anpassad terapi, i linje med den bredare rörelsen mot precisionsmedicin.
Marknadsmöjligheter expandera bortom traditionella geografier, med framväxande ekonomier i Asien-Stillahavsområdet och Latinamerika som visar ökad adoption tack vare ökade investeringar i vårdinfrastruktur och större medvetenhet om avancerade kardiovaskulära ingrepp. Strategiska partnerskap mellan enhetstillverkare, vårdgivare och akademiska institutioner påskyndar klinisk validering och regulatoriska godkännanden, vilket ytterligare driver marknadspenetrationen. Till exempel strömlinjeformar samarbeten med organisationer som den amerikanska livsmedels- och läkemedelsmyndigheten och Europeiska läkemedelsbyrån vägen för nästa generations IVL-enheter.
För att kapitalisera på dessa möjligheter bör tillverkare prioritera agila innovationscykler, robust eftermarknadsövervakning och omfattande utbildningsprogram för läkare. Att betona hållbarhet i tillverkningsprocesser och motståndskraftiga leveranskedjor kommer också att vara avgörande, med tanke på det ökande fokuset på miljömässiga och sociala riktlinjer inom medicinsk teknik. Dessutom kan utnyttjande av digitala plattformar för utbildning och stöd förbättra läkarens adoption och patientutfall.
Sammanfattningsvis är sektorn för tillverkning av IVL-enheter 2025 redo att dra nytta av teknologiska framsteg, växande global efterfrågan och strategiska samarbeten. Företag som investerar i störande innovation, regulatorisk smidighet och intressentengagemang kommer att vara bäst positionerade att leda i detta dynamiska och konkurrensutsatta landskap.
Bilaga: Metodik, datakällor och marknadstillväxtberäkning (Beräknad CAGR: 13,2% från 2025 till 2030)
Denna bilaga beskriver metodiken, datakällorna och beräkningsmetoden som används för att uppskatta den sammansatta årliga tillväxttakten (CAGR) av 13,2% för marknaden för tillverkning av intravaskulära litotripsienheter (IVL) från 2025 till 2030.
Metodik: Beräkningen av marknadstillväxt baseras på en kombination av primär och sekundär forskning. Primär forskning involverade intervjuer och enkäter med nyckelintressenter, inklusive enhetstillverkare, vårdgivare och regulatoriska myndigheter. Sekundär forskning omfattade analys av årsrapporter, produktportföljer och pressmeddelanden från ledande tillverkare av IVL-enheter, samt data från erkända branschorganisationer och regulatoriska organ.
Datakällor:
- Företags finansiella rapporter och investerares presentationer från stora IVL-enhetstillverkare såsom Shockwave Medical, Inc. och Koninklijke Philips N.V.
- Regulatoriska godkännanden och enhetslistor från myndigheter såsom den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) och Europeiska kommissionen
- Marknadsadoptionsdata och kliniska utfall publicerade av organisationer som American College of Cardiology
- Branschrapporter och teknologiska uppdateringar från professionella organ som MedTech Europe
Beräkning av marknadstillväxt: Den beräknade CAGR på 13,2% beräknades med hjälp av den standardiserade CAGR-formeln:
CAGR = [(Slutvärde / Startvärde) ^ (1 / Antal år)] – 1
Marknadsstorleksprognoser för 2025 och 2030 härleddes från aggregerade försäljningsdata, enhetsleveranser och förväntade regulatoriska godkännanden. Justeringar gjordes för förväntade teknologiska framsteg, förändringar i konkurrenslandskapet och förändrade ersättningspolicyer. Beräkningen förutsätter en stabil regulatorisk miljö och fortsatt klinisk adoption av IVL-teknologin för behandling av förkalkad kranskärls- och perifer artärsjukdom.
Denna metodik säkerställer en robust och transparent metod för marknadsstorlek och tillväxtberäkning, som utnyttjar auktoritativa data från branschledare och regulatoriska myndigheter.
Källor och referenser
- Shockwave Medical, Inc.
- Boston Scientific Corporation
- Medtronic plc
- Europeiska kommissionen
- Europeiska läkemedelsbyrån
- Läkemedels- och medicintekniska enheter (PMDA)
- Internationella standardiseringsorganisationen (ISO)
- Association for the Advancement of Medical Instrumentation (AAMI)
- American College of Cardiology
- Koninklijke Philips N.V.